
Actualización de COVID-19 para Virginia
26de agosto de 2021
Estimado colega:
Gracias por su continua colaboración en la respuesta a la pandemia de COVID-19 . Visite el sitio web del Departamento de Salud de Virginia (VDH, por sus siglas en inglés) para obtener orientación clínica y de salud pública actualizada, datos epidemiológicos y otra información. En esta correspondencia se incluyen actualizaciones sobre los siguientes temas:
- La FDA otorga la aprobación total a la vacuna contra el COVID-19 de Pfizer-BioNTech
- La dosis de refuerzo de la vacuna de ARNm para la población adulta general comenzará a mediados de septiembre
- Administración conjunta de vacunas contra la COVID-19 y la influenza
- Actualizaciones adicionales sobre el virus respiratorio sincitial
La FDA otorga la aprobación total a la vacuna contra el COVID-19 de Pfizer-BioNTech
El 23de agosto de 2021, la Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) otorgó la aprobación total de la primera vacuna contra el COVID-19 , la vacuna contra el COVID-19 de Pfizer-BioNTech, para personas de 16 años o más. La vacuna se comercializará como Comirnaty. La Autorización de Uso de Emergencia (EUA, por sus siglas en inglés) de la FDA para Comirnaty continuará cubriendo a las personas de 12 a 15 años, y la administración de una tercera dosis a ciertas personas inmunodeprimidas de 12 años o más. La vacuna aprobada por la FDA y la vacuna autorizada por la FDA tienen la misma formulación y se pueden usar indistintamente para proporcionar la serie de vacunas contra el COVID-19 sin presentar ningún problema de seguridad o eficacia. El proceso de almacenamiento, manipulación y pedido de la vacuna no ha cambiado. La FDA ha actualizado sus hojas informativas de Comirnaty y Pfizer-BioNTech para los proveedores de atención médica que administran vacunas y para los receptores y cuidadores. El Comité Asesor sobre Prácticas de Inmunización (ACIP, por sus siglas en inglés) de los CDC se reunirá el 30 de agosto para analizar las recomendaciones actualizadas para Comirnaty.
Esta aprobación es un hito importante que debería tranquilizar a cualquier persona preocupada por vacunarse de que las vacunas contra el COVID-19 funcionan y son seguras. Según los resultados del ensayo clínico, Comirnaty tiene una eficacia del 91% en la prevención de la enfermedad COVID-19 . La FDA también llevó a cabo una rigurosa vigilancia de seguridad posterior a la autorización con respecto a los casos de miocarditis y pericarditis. Los datos disponibles a corto plazo sugieren que la mayoría de los individuos se recuperaron por completo, sin embargo, algunos pacientes requirieron apoyo en cuidados intensivos. Se encontró que el riesgo era más alto en los hombres de 12 a 17 años. También se descubrió que el riesgo de miocarditis entre los receptores de la vacuna era mucho menor que el riesgo de miocarditis durante y después de la enfermedad real por COVID-19 .
Con la aprobación total de la FDA, Comirnaty ahora se puede usar en entornos que no son de emergencia. Si bien la aprobación total de la FDA generalmente permite el uso "no indicado" en la etiqueta, la administración de todas las vacunas contra el COVID-19 debe realizarse de acuerdo con los requisitos del Programa de Vacunación contra el COVID-19 de los CDC y las recomendaciones de los CDC, el ACIP y la FDA. Esto se aplica tanto a la EUA como a las vacunas contra el COVID-19 aprobadas por la FDA. No se recomienda el uso no indicado en la etiqueta de ninguna vacuna contra el COVID-19 y podría exponer a los proveedores a los siguientes riesgos:
- Es posible que la administración del producto fuera de etiqueta no esté cubierta por la Ley PREP o la declaración de la Ley PREP; Por lo tanto, es posible que los proveedores no tengan inmunidad frente a las reclamaciones.
- Es posible que las personas que reciben una dosis no indicada en la etiqueta no sean elegibles para recibir una compensación en virtud del Programa de Compensación por Lesiones de Contramedidas después de un posible evento adverso.
- Los CDC han definido el alcance del Programa de Vacunación contra el COVID-19 de los CDC en términos de cómo se pueden usar las vacunas proporcionadas por el gobierno de los EE. UU. en el programa. Los proveedores que administran dosis no indicadas en la etiqueta estarían violando el acuerdo de proveedores del Programa de los CDC, lo que podría afectar su capacidad para seguir siendo proveedores en el programa de los CDC.
- Es posible que los pagadores no reembolsen las tarifas administrativas.
Las vacunas de Moderna y Johnson & Johnson continuarán administrándose de manera segura a través de una EUA mientras la FDA revisa los datos sobre su uso en el mundo real.
La dosis de refuerzo de la vacuna de ARNm para la población general comenzará a mediados de septiembre
El 18de agosto de 2021, el Departamento de Salud y Servicios Humanos de EE. UU. (HHS, por sus siglas en inglés) emitió una declaración conjunta en la que anunciaba el plan de la Administración para las dosis de refuerzo contra el COVID-19 para la población general que ha recibido una serie completa de una vacuna de ARNm. Una dosis de refuerzo se refiere a una dosis de vacuna administrada cuando es probable que la respuesta inmunitaria inicial suficiente a una serie primaria de vacunas haya disminuido con el tiempo. Aunque las vacunas contra el COVID-19 continúan brindando una fuerte protección contra la enfermedad grave, la hospitalización y la muerte, la evidencia reciente muestra que la protección contra la enfermedad19 leve y moderada disminuye con el tiempo en ciertas personas. Existe la preocupación de que la protección contra los peores resultados de la COVID-19 pueda debilitarse en los próximos meses, especialmente entre las personas que corren un mayor riesgo de enfermarse gravemente o que fueron vacunadas durante las primeras fases del lanzamiento de la vacuna. En respuesta, VDH emitió un comunicado de prensa y actualizó sus preguntas frecuentes sobre la vacunación para el público y los proveedores de atención médica.
Sobre la base de estos datos emergentes, el plan propuesto actualmente es que cualquier persona de 18 años o más que haya recibido dos dosis de la vacuna de Pfizer-BioNTech (Comirnaty) o Moderna debe planificar recibir una dosis de refuerzo al menos ocho meses después de recibir la segunda dosis a partir de la semana de septiembre de 20de 2021. Estas recomendaciones (incluido el cronograma) podrían cambiar según los procesos de revisión de la FDA, el ACIP y los CDC. No se recomiendan los refuerzos en este momento. La reunión del ACIP del 30 de agosto incluirá una discusión sobre las dosis de refuerzo. Revise los sitios web de los CDC y VDH para obtener la información más actualizada, ya que esta información está sujeta a cambios; Enviaremos una actualización tan pronto como tengamos más información.
En el momento del anuncio del HHS, no se recomendaba una dosis de refuerzo para aquellos que recibieron la vacuna de Johnson & Johnson porque los datos de los ensayos clínicos necesarios para tomar esta decisión no estaban disponibles. El 25de agosto de 2019, Johnson & Johnson informó que las personas vacunadas tenían una fuerte protección que persistía durante ocho meses y que una dosis de refuerzo generó un aumento sustancial en los anticuerpos que se unen a la espícula en personas de 18a55 años y en aquellos de 65 años o más que recibieron una dosis de refuerzo más baja. Es probable que la FDA y los CDC revisen estos datos para informar las recomendaciones de refuerzo para este producto.
En preparación para las dosis de refuerzo, debemos asegurarnos de que haya suficientes proveedores de vacunas contra la COVID-19 para satisfacer la demanda. Si aún no lo ha hecho, considere convertirse en un proveedor para apoyar a su comunidad. Para obtener más información, visite la página web de VDH Inscripción de proveedores Página. Además, el Intercambio de Administración y Asignación de Vacunas de Virginia (VaxMax) proporciona recursos para el pedido, la administración y la distribución de vacunas para los proveedores de atención médica participantes. Si su consultorio estaba preocupado antes por la gran cantidad de tamaño mínimo de pedido, Virginia ahora tiene un Programa de Redistribución de Envíos Pequeños que puede proporcionar cantidades más pequeñas a las oficinas de los proveedores. Considere inscribirse como proveedor de vacunas contra el COVID-19 hoy.
Administración conjunta de vacunas contra la COVID-19 y la influenza
Con la llegada de la temporada de influenza (gripe), puede haber ventajas logísticas convincentes al ofrecer a los pacientes las vacunas contra el COVID-19 y la influenza el mismo día. Por CConsideraciones clínicas de DC para las vacunas contra el COVID-19 , puede administrar de manera segura las vacunas contra el COVID-19 y la influenza (tanto las vacunas contra la influenza vivas como las vacunas no vivas contra la influenza) sin importar el tiempo. Esto incluye la administración de vacunas contra el COVID-19 y la gripe el mismo día y la administración conjunta dentro de los 14 días. A la hora de decidir si se administran conjuntamente las vacunas, tenga en cuenta lo siguiente:
- Si el paciente está atrasado o corre el riesgo de atrasarse en las vacunas recomendadas
- El riesgo del paciente de contraer una enfermedad prevenible con vacunación.
- El perfil de reactogenicidad de las vacunas
- La probabilidad de evitar una oportunidad perdida de vacunar
Las mejores prácticas para administrar varias vacunas incluyen las siguientes:
- Etiquete cada jeringa con el nombre y la dosis (cantidad) de la vacuna, el número de lote, las iniciales del preparador y el tiempo exacto después de su uso, si corresponde.
- Separe los sitios de inyección por 1 pulgada o más, si es posible.
- Administre las vacunas contra el COVID-19 y las vacunas que puedan tener más probabilidades de causar una reacción local (es decir, vacunas contra la influenza con coadyuvantes) en diferentes extremidades, si es posible.
La vacunación contra la influenza reducirá la carga de enfermedades, hospitalizaciones y muertes por influenza en el sistema de atención médica y ayudará a conservar los recursos de atención médica para el COVID-19 y otras afecciones.
Actualizaciones adicionales sobre el virus respiratorio sincitial
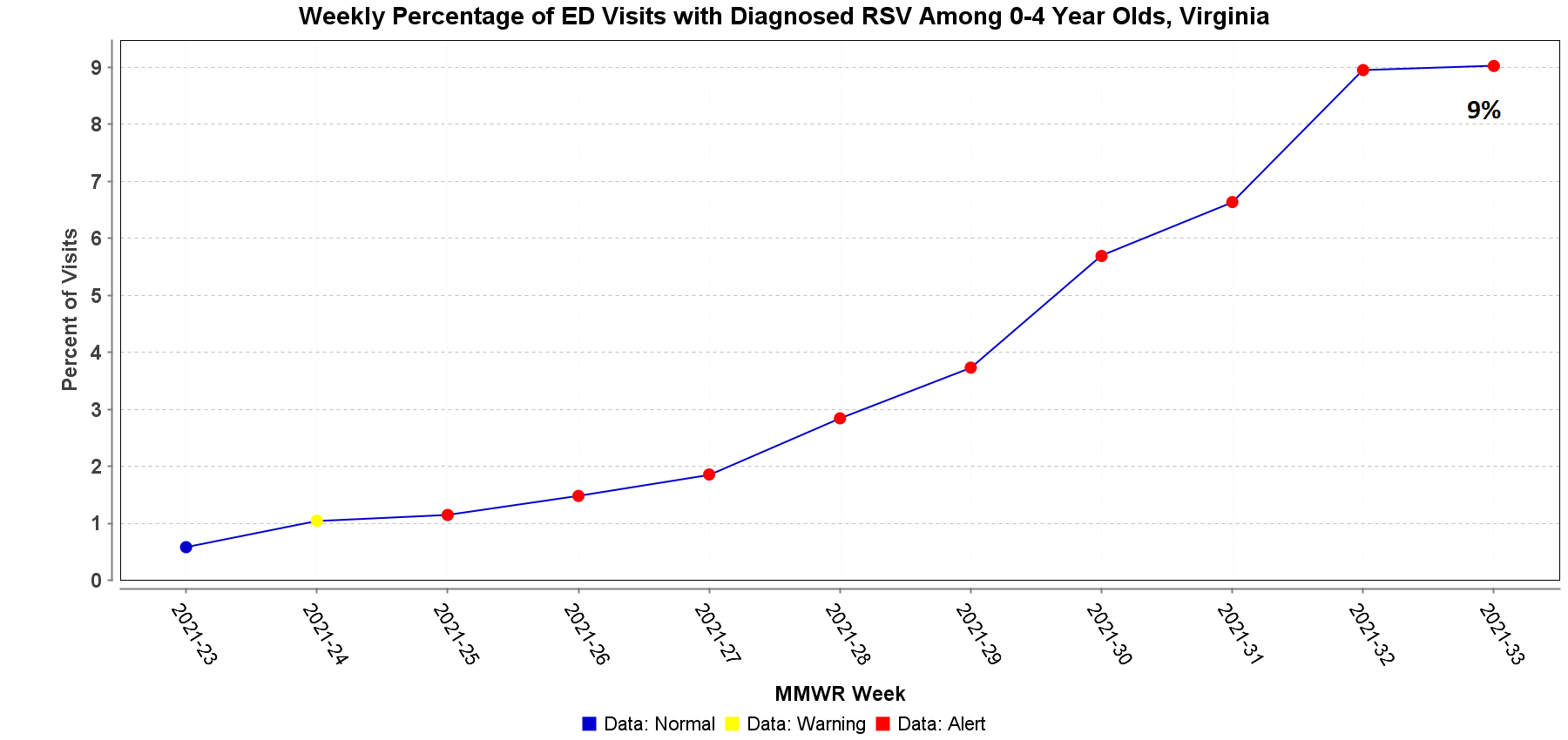
En nuestra carta de agosto de 6 2021 Estimado colega, proporcionamos información sobre la profilaxis del virus respiratorio sincitial (VRS). Desde entonces, la Academia Americana de Pediatría (American Academy of Pediatrics, AAP) ha actualizado sus directrices provisionales para la profilaxis con palivizumab. La AAP apoya firmemente a los proveedores para que consideren el uso de palivizumab en pacientes que serían candidatos según las recomendaciones de elegibilidad actuales. La guía revisada actualiza el momento en que se debe administrar palivizumab para tener en cuenta la estacionalidad alterada del VRS este año. La recomendación de la AAP se aplica a las regiones con altas tasas de circulación del VRS, lo que coincide con una temporada típica de otoño-invierno. El VDH ha visto un aumento en el número de brotes de VRS reportados. Hasta el momento, el número de brotes de VRS notificados fue de uno en junio, tres en julio y once en agosto. Durante la semana del del 15 al 21 de agosto, el 9% de las visitas al departamento de emergencias entre los niños de 0 a 4 años en Virginia fueron diagnosticados con VRS.
Como siempre, les agradezco sinceramente su continua colaboración durante estos tiempos difíciles. Si tiene preguntas sobre COVID-19, comuníquese con su departamento de salud local.
Atentamente,
M. Norman Oliver, MD, MA
Comisionado Estatal de Salud
